|
|||||||||||||||
Все документы, представленные в каталоге, не являются их официальным изданием и предназначены исключительно для ознакомительных целей. Электронные копии этих документов могут распространяться без всяких ограничений. Вы можете размещать информацию с этого сайта на любом другом сайте.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
Охрана природы РЕКУЛЬТИВАЦИЯ ЗЕМЕЛЬМетод измерения и расчета суммы токсичных солей во
вскрышных Nature protection. Recultivation of lands. Method of measurement |
ГОСТ
|
Постановлением Государственного комитета СССР по стандартам от 28.02.84 № 639 дата введения установлена
01.07.85
Содержание
Настоящий стандарт устанавливает метод измерения и расчета суммы токсичных солей в водной вытяжке во вскрышных и вмещающих породах.
Метод основан на количественном анализе ионного состава водных вытяжек пород и на последующем расчетном и графическом измерении концентрации в породах легкорастворимых токсичных солей.
Стандарт не распространяется на вскрышные и вмещающие породы с реакцией среды - рН водной вытяжки менее 5,5; на скальные: магматические, метаморфические, осадочные сцементированные крупно- и мелкообломочные грунты с прочным цементом, биохимические по ГОСТ 25100-95 и породы, содержащие радиоактивные элементы и токсичные соединения в концентрациях, опасных для жизни человека и животных.
1. МЕТОД ОТБОРА ПРОБ
1.1. Отбор, транспортировка и хранение образцов вскрышных и вмещающих пород из кернов разведочного бурения, с борта рабочих траншей и карьеров или их смесей с отвалов производится по ГОСТ 12071-2000.
1.2. Перед анализом образец породы должен быть доведен до воздушно-сухого состояния. Помещение для сушки должно быть хорошо проветриваемое и защищенное от доступа паров кислот, аммиака и других лабораторных газов. Породу измельчают при помощи пробоизмельчителя с размером ячеек сита 2 мм, хорошо перемешивают и распределяют по ровной поверхности слоем толщиной не более 1 см. Пробу для анализа отбирают ложкой или шпателем не менее чем из пяти разных мест, равномерно расположенных по площади.
2. АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ
Весы лабораторные 1-го класса точности с предельной нагрузкой 200 г и весы лабораторные 4-го класса точности с предельной нагрузкой 500 г по ГОСТ 24104-88*.
___________
* С 1 июля 2002 г. введен в действие ГОСТ 24104-2001.
Шкаф сушильный с рабочим диапазоном температур - от температуры окружающей среды до температуры +200 °С, с автоматическим регулятором температуры; допустимая погрешность регулирования температуры ±2 °С.
Фотометр пламенный типа ППФ УНИИЗ с наименьшей определяемой концентрацией натрия, калия и кальция - 0,5 мг/дм3 или 5·10-5%, при использовании ацетилено-воздушного пламени, пропан - бутана или смеси светильного газа с воздухом давление воздуха в выходной камере редуктора не должно превышать 100-150 кПа, а давление газа - 40 мм вод. ст.
Пробоизмельчитель почвенный типа ПП-2 с размером ячеек сита 2 мм, масса измельчаемой пробы 500 г, частота вращения рабочего органа 25 с-1, мощность электродвигателя 1100 Вт и другие аналогичные приборы.
Эксикатор по ГОСТ 25336-82, заполненный хлористым кальцием по нормативно-техническому документу (НТД) или другим поглотителем водяных паров.
Мешалка магнитная для перемешивания раствора при титровании.
Баня водяная или песчаная.
Установки фильтровальные десятипозиционные.
Ротатор типа Р-120 для взбалтывания почвенных суспензий с оборотом емкостей на 360°, с частотой вращения 30/60-40/60 с-1 или встряхиватель с возвратно-поступательным движением с частотой колебаний 75 цикл/мин.
Бумага фильтровальная лабораторная марок ФОС и ФОМ по ГОСТ 12026-76.
Штативы металлические для ионообменных колонок.
Колбы конические по ГОСТ 25336-82, вместимостью 100; 150; 250; 500 и 1000 см3.
Цилиндры по ГОСТ 1770-74, вместимостью 10; 25; 50; 100; 250; 500 см3.
Колбы мерные 2-го класса точности по ГОСТ 1770-74, вместимостью 500 и 1000 см3.
Стаканы химические по ГОСТ 25336-82, вместимостью 50; 150; 250 см3.
Пипетки по ГОСТ 29227-91, 2-го класса точности, вместимостью 1; 5; 10; 20; 25; 50; 100 см3.
Бюретки по ГОСТ 29251-91, 2-го класса точности, вместимостью 25; 50 см3.
Колонки стеклянные для катионита длиной 46-47 см и диаметром 1,5 см или воронки с фильтрующей стеклянной пластинкой - нутчи № 1 и 2.
Чашки фарфоровые по ГОСТ 9147-80.
Капельницы лабораторные стеклянные по ГОСТ 25336-82.
Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82.
Аммоний хлористый по ГОСТ 3773-72, ч.д.а.
Аммиак водный по ГОСТ 3760-79, х.ч., 25%-ный раствор.
Ацетон по ГОСТ 2603-79, ч.д.а.
Кислота азотная по ГОСТ 4461-77, ч.д.а.
Серебро азотнокислое по ГОСТ 1277-75, ч.д.а.
Барий хлористый по ГОСТ 4108-72, ч.д.а.
Вода дистиллированная по ГОСТ 6709-72.
Натрия диэтилдитиокарбамат по ГОСТ 8864-71.
Гидроксиламин гидрохлорид по ГОСТ 5456-79.
Калий хромовокислый по ГОСТ 4459-75, ч.д.а.
Калий роданистый (роданид) по ГОСТ 4139-75.
Кальций хлористый по НТД, ч.д.а.
Катионит КУ-2 или КУ-2 - 8 по ГОСТ 20298-74.
Хром темно-синий кислотный (индикатор) по ГОСТ 14091-78.
Метиловый оранжевый (индикатор) по НТД.
Натрий тетраборнокислый 10-водный по ГОСТ 4199-76, х.ч.
Натрия гидроокись по ГОСТ 4328-77, ч.д.а.
Нитхромазо (индикатор).
Натрий хлористый по ГОСТ 4233-77, х.ч.
Сахароза по ГОСТ 5833-75, ч.д.а.
Спирт этиловый ректификованный по ГОСТ 5962-67*.
Кислота соляная по ГОСТ 3118-77.
Кислота серная по ГОСТ 4204-77.
Фенолфталеин по НТД.
Соль динатриевая этилендиамин - N,N,N,N-тетрауксусной кислоты, двуводная (трилон Б) по ГОСТ 10652-73.
Бумага индикаторная универсальная по ГОСТ 4919.1-77.
Бумага конго по ГОСТ 4919.1-77.
Цинк гранулированный по НТД.
___________
*На территории Российской Федерации действует ГОСТ Р 51652-2000.
3. ПОДГОТОВКА К АНАЛИЗУ
3.1. Из аналитической пробы берут две навески породы для определения гигроскопической влажности по ГОСТ 5180-84.
3.2. Приготовление водной вытяжки
30-100 г сухой породы, то есть с учетом значения гигроскопической влажности, помещают в коническую колбу вместимостью 0,5-1,0 дм3, приливают пятикратное количество свежеприготовленной дистиллированной воды. Колбу закрывают резиновой пробкой и взбалтывают 3 мин.
Водную вытяжку отфильтровывают через двойной складчатый фильтр. Фильтр должен лежать в воронке на 0,5-1,0 см ниже ее края. Содержимое колбы встряхивают и переносят всю массу навески на фильтр. Струю суспензии следует направлять на боковую стенку фильтра. Первые мутные порции фильтрата собирают в колбу с суспензией. Перефильтровывают фильтрат до тех пор, пока он не будет совершенно прозрачным. Собирают фильтрат в чистый приемник - коническую колбу вместимостью 250-500 см3.
При длительном фильтровании для защиты вытяжки от испарения воронку накрывают покровным стеклом или надевают сверху полиэтиленовый пакет, а в горло колбы вставляют тампон из ваты.
3.3. К анализу следует приступать после окончания фильтрации. Необходимо начинать с измерения общей щелочности, поскольку последняя при стоянии водной вытяжки может измениться.
3.4. При анализе водной вытяжки следует проводить холостой опыт с дистиллированной водой, результат которого вычитают из результатов каждого измерения.
3.5. Перед отбором фильтрата на анализ водную вытяжку следует перемешать круговым движением.
3.6. Приготовление растворов для анализа водной вытяжки.
3.6.1. Растворы индикаторов - 0,1%-ный водный раствор метилового оранжевого и 1,0%-ный раствор фенолфталеина готовят по ГОСТ 4919.1-77.
3.6.2. Приготовление 0,1%-ного раствора нитхромазо
0,1 г индикатора взвешивают с допустимой погрешностью ±0,01 г, помещают в мерную колбу вместимостью 100 см3, растворяют в дистиллированной воде. Объем раствора в колбе доводят дистиллированной водой до метки.
3.6.3. Приготовление титрованного раствора серной кислоты с (1/2H2SO4) = 0,02 моль/дм3 (0,02 н)
0,56 см3 серной кислоты, плотностью 1,84 г/см3, помещают в мерную колбу вместимостью 1 дм3, доводят дистиллированной водой до метки и перемешивают. Титр раствора серной кислоты устанавливают по натрию тетраборнокислому массовой концентрации 3,82 г/дм3.
3.6.4. Приготовление 1%-ного раствора азотнокислого серебра (AgNO3)
1 г азотнокислого серебра взвешивают с погрешностью не более ±0,1 г и помещают в мерную колбу вместимостью 100 см3. Растворяют дистиллированной водой, объем раствора в колбе доводят до метки и перемешивают.
3.6.5. Приготовление 10%-ного раствора хромовокислого калия (K2CrO4)
100 г хромовокислого калия взвешивают с погрешностью не более ±0,1 г, помещают в мерную колбу вместимостью 1 дм3 и растворяют в дистиллированной воде. Объем раствора в колбе доводят дистиллированной водой до метки и перемешивают.
3.6.6. Приготовление титрованного раствора азотнокислого серебра c (AgNO3) = 0,02 моль/дм3 (0,02 н)
3,40 г азотнокислого серебра помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде и перемешивают. Объем раствора в колбе доводят дистиллированной водой до метки и вновь перемешивают. Раствор отстаивают в течение 2 сут., сливают отстоявшийся раствор и устанавливают его молярную концентрацию эквивалента по раствору хлористого натрия той же концентрации.
3.6.7. Приготовление раствора хлористого натрия c (NaCl) = 0,02 моль/дм3 (0,02 н)
1,169 г хлористого натрия помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде и перемешивают. Объем раствора в колбе доводят дистиллированной водой до метки и вновь перемешивают.
3.6.8. Приготовление титрованного раствора хлористого бария с (1/2ВаСl2) = 0,02 моль/дм3 (0,02 н)
2,0828 г хлористого бария или 2,4428 г ВаСl2·2Н2О помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде и перемешивают. Объем раствора в колбе доводят дистиллированной водой до метки и вновь перемешивают. Титр раствора проверяют по серной кислоте, приготовленной как указано в п. 3.6.3.
3.6.9. Приготовление 5%-ного раствора соляной кислоты
115,2 см3 соляной кислоты (плотность 1,19 г/см3) помещают в мерную колбу вместимостью 1 дм3, доливают дистиллированную воду до метки и перемешивают.
3.6.10. Приготовление раствора соляной кислоты с (НСl) = 0,1 моль/дм3 (0,1 н) по ГОСТ 4919.1-77
3.6.11. Приготовление разбавленного раствора соляной кислоты в соотношении 1:4
К одному объему соляной кислоты (плотность 1,19 г/см3) прибавляют четыре объема дистиллированной воды.
3.6.12. Приготовление 10%-ного раствора роданистого калия (роданид)
10 г роданистого калия взвешивают с погрешностью ±0,1 г, помещают в мерную колбу вместимостью 100 см3 и растворяют дистиллированной водой. Объем раствора в колбе доводят дистиллированной водой до метки и перемешивают.
3.6.13. Приготовление хлоридоаммиачного буферного раствора с рН 10
20 г хлористого аммония помещают в мерную колбу вместимостью 1 дм3, растворяют в 100 см3 дистиллированной воды, добавляют 100 см3 25%-ного раствора аммиака и перемешивают. Объем раствора в колбе доводят дистиллированной водой до метки и вновь перемешивают.
3.6.14. Приготовление индикатора кислотного хром темно-синего
0,20 г кислотного хром темно-синего растворяют в 10 см3 аммиачного буферного раствора с рН 10 и разбавляют до 100 см3 этиловым спиртом. Раствор годен к употреблению не более 1 мес.
3.6.15. Приготовление титрованного раствора соли динатриевой этилендиамина - N,N,N,N-memрауксусной кислоты, двуводной (трилон Б) c (l/2C10H14O8N2Na2·2Н2О) = 0,025 моль/дм3 (0,05 н)
9,31 г трилона Б помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде и перемешивают. Объем раствора в колбе доводят дистиллированной водой до метки и вновь перемешивают. Титр раствора устанавливают по раствору хлористого цинка, приготовленному как указано в п. 3.6.16.
3.6.16. Приготовление титрованного раствора хлористого цинка с (l/2ZnCl2) = 0,05 моль/дм3 (0,05 н)
1,6345 г гранулированного цинка помещают в мерную колбу вместимостью 1 дм3 и приливают 20-30 см3 концентрированной соляной кислоты, прикрывают колбу часовым стеклом, слегка подогревают раствор на водяной бане для более быстрого растворения, периодически перемешивая раствор до полного растворения цинка. Объем раствора в колбе доводят дистиллированной водой до метки и тщательно перемешивают. Приготовление раствора хлористого цинка проводят под тягой.
3.6.17. Приготовление 20%-ного раствора натрия гидроокиси (NaOH)
200 г гидроокиси натрия помещают в толстостенный фарфоровый стакан, осторожно приливают 800 см3 дистиллированной воды, (приготовленной по ГОСТ 4517-87) небольшими порциями при постоянном помешивании стеклянной палочкой, так как растворение сопровождается сильным разогреванием. Раствор оставляют на сутки, закрыв стеклом или фильтром. Затем сливают в бутыль или в колбу вместимостью 1 дм3. Приготовление реактива следует проводить под тягой и обращаться с ним осторожно, так как гидроокись натрия сильно разъедает кожу. Измельчение натрия гидроокиси необходимо проводить в защитных очках и в резиновых перчатках.
3.6.18. Приготовить раствор соляной кислоты, разбавленный 1:1.
3.6.19. Приготовление исходного градуировочного раствора хлористого натрия для пламенно-фотометрического метода измерения натрия
2,5422 г хлористого натрия помещают в мерную колбу вместимостью 1 дм3, растворяют в дистиллированной воде и доводят раствор дистиллированной водой до метки. Концентрированный градуировочный раствор содержит 1 мг ионов натрия в 1 см3.
Приготовление рабочих растворов сравнения: отмеряют бюреткой исходный градуировочный раствор хлористого натрия в мерные колбы вместимостью 500 см3 в количествах, указанных в таблице.
Номер рабочего раствора сравнения |
1 |
2 |
3 |
4 |
5 |
6 |
|
Количество исходного градуировочного раствора, см3 |
5 |
10 |
25 |
50 |
75 |
100 |
|
Массовая концентрация ионов натрия, мг/дм3 |
10 |
20 |
50 |
100 |
150 |
200 |
Объем раствора в колбах доводят дистиллированной водой до метки и тщательно перемешивают. Срок хранения исходного градуировочного раствора хлористого натрия и рабочих растворов сравнения - 1 год.
3.7. Подготовка ионообменных колонок
8-10 г воздушно-сухой массы катионита размельчают до 0,5-1,0 мм, промывают дистиллированной водой до полного удаления пыли, заливают разбавленным раствором соляной кислоты (1:4), перемешивают и оставляют стоять до следующего дня. После отстаивания раствор кислоты сливают и заменяют свежим, отстаивают 5-10 мин, снова сливают и продолжают обработку до тех пор, пока проба с роданидом не покажет отсутствие железа в растворе. Катионит промывают один-два раза дистиллированной водой и водную суспензию катионита переносят в ионообменную колонку. В колонке катионит промывают дистиллированной водой до отсутствия реакции на хлор (проба с 1%-ным раствором азотнокислого серебра).
После каждого измерения концентрации сульфат-ионов катионит в колонке необходимо регенерировать, для чего через каждую колонку следует пропустить 150-200 см3 5%-ного раствора соляной кислоты, а затем отмыть смолу дистиллированной водой до рН 5,0 (по универсальной индикаторной бумаге) или до исчезновения реакции на хлорид-ион. В заряженных колонках катионит следует хранить во влажном состоянии.
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1.Весовой метод измерения растворимых в воде веществ (сухой остаток)
50-100 см3 водной вытяжки помещают в фарфоровую чашку или бюксу, предварительно высушенные в сушильном шкафу при температуре 100-105 °С до постоянной массы. Водную вытяжку выпаривают досуха на водяной бане, сушат 3 ч в сушильном шкафу при температуре 100-105 °С, после чего охлаждают в эксикаторе 30 мин и взвешивают на лабораторных весах 1-го класса точности. За результат взвешивания принимают наименьшую массу навески.
При высоком хлоридном засолении пород для устранения гигроскопичности сухого остатка выпаривание водной вытяжки следует проводить с углекислым натрием (безводным), высушенным до постоянной массы при температуре +200 °С. Углекислый натрий добавляют из расчета 2-3 г на 100 см3 вытяжки.
4.2. Измерение ионного состава водной вытяжки
Измерение ионного состава водной вытяжки проводят в том случае, когда сухой остаток превышает 0,15 % от массы породы.
4.2.1. Ацидиметрический метод измерения бикарбонат ионов (НСО3¯) - определение общей щелочности
Метод основан на титровании водной вытяжки раствором серной кислоты до рН 4,4.
25-50 см3 водной вытяжки отбирают пипеткой, помещают в коническую колбу вместимостью 100-150 см3 и добавляют 2 капли 1%-ного раствора фенолфталеина. При появлении малиновой окраски титруют раствором серной кислоты с (1/2H2SO4) = 0,02 моль/дм3 до исчезновения окраски. По окончании титрования в ту же водную вытяжку добавляют 2 капли 0,1%-ного раствора метилового оранжевого и титруют тем же раствором серной кислоты до изменения окраски индикатора из желтой в оранжевую.
Для более точного измерения точки эквивалентности титрование следует проводить со «свидетелем», в качестве которого служит колбочка такого же объема и с таким же количеством водной вытяжки и индикатора. Титрование проводят на белом фоне.
4.2.2. Аргентометрический метод измерения хлорид-ионов (Сl-)
Метод основан на титровании хлорид-ионов раствором азотно-кислого серебра. При этом ионы серебра связываются с ионами хлора в труднорастворимое соединение - хлористое серебро в присутствии хромат-ионов как индикатора.
Перед началом анализа проводят качественную пробу на определение массовой концентрации хлорид-ионов, в зависимости от результатов которой определяется объем водной вытяжки, необходимый для количественного измерения (молярной концентрации эквивалента) хлорид-ионов.
5 см3 водной вытяжки подкисляют 2-3 каплями азотной кислоты (плотность 1,40 г/см3) без соляной кислоты, прибавляют 3-5 капель 1%-ного раствора азотнокислого серебра и взбалтывают. По величине осадка устанавливают объем водной вытяжки: при большом хлопьевидном осадке на анализ следует брать 5 см3 водной вытяжки, при образовании сильной мути - 10 см3. Малые объемы водной вытяжки следует разбавить дистиллированной водой до 25-50 см3. При образовании слабой мути берут 20-25 см3 водной вытяжки, а при опалесценции - 50 см3 и более. Большие объемы водной вытяжки упаривают до 25-50 см3. При малой или большой концентрации хлорид-ионов в водной вытяжке измерения проводят в отдельной пробе, объем которой устанавливают соответственно показаниям качественной пробы.
К пробам бесцветной водной вытяжки, в которых была оттитрована общая щелолочность, добавляют 1 см3 10%-ного раствора хромовокислого калия и титруют раствором азотнокислого серебра с (AgNO3) = 0,02 моль/дм3 до появления неисчезающей красно-бурой окраски.
4.2.3. Объемный метод измерения сульфат ионов (SO42-) в присутствии индикатора нитхромазо
Метод основан на титровании сульфат-ионов раствором хлористого бария в присутствии нитхромазо в качестве металл-индикатора.
40-50 см3 водной вытяжки пропускают через ионообменную колонку с катионитом. Концентрация сульфат-ионов в растворе должна быть 0,04-5,00 мг в пересчете на серу в титруемой пробе. При меньшей концентрации сульфат-иона раствор следует концентрировать выпариванием, при большей концентрации необходимо его разбавить. Первые порции фильтрата (10-15 см3) отбрасывают. Отбирают пипеткой 10-20 см3 фильтрата в коническую колбу вместимостью 100 см3. Определяют рН раствора по индикаторной бумаге (рН должен быть 1,7-2,0). При необходимости, раствор следует подкислить соляной кислотой с (НСl) = 0,1 моль/дм3 или разбавить, если концентрация сульфат-иона достаточно велика. В раствор вносят 1-2 капли нитхромазо, 10-20 см3 ацетона или спирта и титруют хлористым барием с (1/2ВаСl2) = 0,02 моль/дм3 до перехода фиолетовой окраски в голубую. Титрование проводят медленно, прибавляя хлористый барий по каплям и тщательно перемешивая. При малой концентрации судьфат-ионов в водной вытяжке от первых капель хлористого бария появляется голубая окраска, которая через 30-40 с снова переходит в фиолетовую. Конец титрования отмечается четким переходом фиолетовой окраски в голубую, не изменяющуюся в течение 1-2 мин.
4.2.4. Комплексонометрический метод измерения ионов кальция (Са2+) и магния (Mg2+) в одном объеме фильтрата по металл-индикатору кислотному хром темно-синему
4.2.4.1. Определение иона кальция
25 см3 водной вытяжки помещают в коническую колбу вместимостью 250 см3, прибавляют около 0,1 г кристаллического гидроксиламина и 0,03-0,04 г диэтилдитиокарбамата натрия, тщательно перемешивают, приливают 10 см3 20%-ного раствора гидроокиси натрия, разбавляют дистиллированной водой до 200 см3, приливают раствор индикатора кислотного хром темно-синего до ярко-розовой окраски и титруют раствором трилона Б. Титрование ведут до появления устойчивой синевато-сиреневой окраски в точке эквивалентности. При большом содержании магния в анализируемом растворе он выпадает в осадок в щелочной среде. В этом случае определение вновь повторяют, предварительно внеся в раствор 0,1-0,2 г сахарозы.
4.2.4.2. Определение иона магния
В оттитрованный раствор бросают кусочек бумажки конго и прибавляют по каплям разбавленный раствор соляной кислоты (1:1) до посинения индикаторной бумажки. Щелочность раствора снижается и появляется розовая окраска индикатора кислотного хром темно-синего. Прибавляют 25%-ный раствор аммиака до посинения раствора и покраснения бумажки конго. Прибавляют 20 см3 аммиачного буферного раствора с рН 10. При наличии магния раствор окрашивается индикатором в розово-красный цвет.
Если окраска слабая, прибавляют еще несколько капель индикатора кислотного хром темно-синего и титруют раствором трилона Б до синевато-сиреневой окраски индикатора в точке эквивалентности.
4.2.5. Пламенно-фотометрический метод измерения ионов натрия (Na+)
Метод основан на измерении интенсивности излучения натрия, вводимого в пламя в виде аэрозоля.
Растворы сравнения измеряют на пламенном фотометре, используя светофильтр, пропускающий аналитические линии 589,0 и 589,6 нм. Строят градуировочный график, откладывая по оси абсцисс массовые концентрации натрия в растворах сравнения. По оси ординат откладывают соответствующие им показания прибора. Каждая точка градуировочного графика должна представлять собой среднее арифметическое трех результатов. Градуировочный график необходимо проверять в начале, в середине и в конце работы на приборе.
Анализируемые растворы водных вытяжек вводят в пламенный фотометр, снимают показания прибора и по графику находят концентрацию натрия в растворе.
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. При весовом методе измерения и расчета общей суммы растворимых в воде веществ (сухой остаток) массовую долю сухого остатка (W) в процентах вычисляют по формуле
![]()
где m - масса чашки (бюксы) с массой сухого остатка, г;
m1 - масса чашки (бюксы), г;
m2 - масса навески породы, соответствующая объему водной вытяжки, взятой для выпаривания, г;
100 - коэффициент пересчета в проценты.
За результат анализа принимают среднеарифметическое результатов двух параллельных измерений, допускаемые расхождения между которыми не должны превышать 0,2 % от определяемого значения.
5.2. При ацидиметрическом методе измерения бикарбонат ионов (определение общей щелочности) молярную концентрацию эквивалента бикарбонат-ионов с (НСО3¯) в моль/дм3 вычисляют по формуле
![]()
где А - молярная концентрация эквивалента серной кислоты с (1/2H2SO4) = 0,02 моль/дм3 (0,02 н);
V1 - объем серной кислоты, израсходованный на титрование общей щелочности по фенолфталеину (первое титрование), дм3;
V2 - объем серной кислоты, израсходованный на титрование общей щелочности по метиловому оранжевому (второе титрование), дм3;
V3 - объем водной вытяжки, взятый на титрование, дм3.
За результат анализа принимают значение единичного определения общей щелочности. Допускаемые, при вероятности Р = 0,99, отклонения от аттестованного значения стандартного образца или среднеарифметического при выборочном повторном анализе составляют V%, при молярной концентрации эквивалента бикарбонат-ионов:
до 0,0028 моль/дм3 - 7,5;
свыше 0,0028 до 0,0050 моль/дм3 - 7,5;
свыше 0,0050 моль/дм3 - 6,0.
5.3. При аргентометрическом методе измерения хлорид-ионов молярную концентрацию эквивалента хлорид-ионов с (Сl-) в моль/дм3 вычисляют по формуле
![]()
где А - молярная концентрация эквивалента азотнокислого серебра с (AgNO3) = 0,02 моль/дм3 (0,02 н);
V1 - объем азотнокислого серебра, израсходованный на титрование хлорид-иона, дм3;
V2 - объем фильтрата водной вытяжки, взятый на титрование, дм3.
За результат анализа принимают значение единичного определения хлорид-иона.
Допускаемые, при вероятности Р = 0,99, отклонения от аттестованного значения стандартного образца или от среднеарифметического при выборочном повторном анализе составляют, V%, при молярной концентрации эквивалента хлорид-иона:
свыше 0,0006 до 0,0018 моль/дм3 - 12;
свыше 0,0018 до 0,0056 моль/дм3 - 9;
свыше 0,0056 моль/дм3 - 6.
5.4. При объемном методе измерения сульфат-ионов с (1/2SO24 ) молярную концентрацию эквивалента сульфат-ионов в моль/дм3 вычисляют по формуле
![]()
где А -молярная концентрация эквивалента хлористого бария с (1/2ВаСl2) = 0,02 моль/дм3;
V1 - объем хлористого бария, израсходованный на титрование, дм3;
V2 - объем фильтрата водной вытяжки, взятый на титрование, дм3.
За результат анализа принимают значение единичного определения сульфат-иона.
Допускаемые, при вероятности Р = 0,99, отклонения от аттестованного значения стандартного образца или от среднеарифметического при выборочном повторном анализе составляют, V%, при молярной концентрации эквивалента сульфат-иона:
свыше 0,0034 до 0,0070 моль/дм3 - 7,5;
свыше 0,0070 до 0,0140 моль/дм3 - 6;
свыше 0,0140 моль/дм3 - 5.
5.5. При комплексонометрическом измерении молярные концентрации эквивалентов ионов кальция (Са2+) и магния (Mg2+) в моль/дм3 вычисляют по формулам:
![]()
![]()
где А - молярная концентрация трилона Б с (C10Hl4O8N2Na2·2Н2О) = 0,025 моль/дм3;
V1 - объем раствора трилона Б, израсходованный на титрование ионов кальция, дм3 (первое титрование);
V2 - объем раствора трилона Б, израсходованный на титрование ионов магния, дм3 (второе титрование);
V3 - объем водной вытяжки, взятый на титрование, дм3;
2 - коэффициент перевода с (Са2+) и с (Mg2+) в с (1/2Са2+) и в c (1/2Mg2+).
За результат анализа принимают значение единичного определения ионов кальция и магния. Допускаемые, при вероятности Р = 0,99, отклонения от аттестованного значения стандартного образца или от среднеарифметического при выборочном повторном анализе составляют, V%, при молярной концентрации эквивалента ионов кальция:
до 0,0100 моль/дм3 - 7,5;
свыше 0,0100 до 0,0200 моль/дм3 - 6;
свыше 0,0200 моль/дм3 - 6;
при молярной концентрации эквивалента ионов магния:
до 0,0060 моль/дм3 - 9;
свыше 0,0060 до 0,0120 моль/дм3 - 9;
свыше 0,0120 до 0,0180 моль/дм3 - 7,5;
свыше 0,0180 моль/дм3 - 6.
5.6. При пламенно-фотометрическом методе молярную концентрацию эквивалента ионов натрия с (Na+) в моль/дм3 вычисляют по формуле
![]()
где В - массовая концентрация ионов натрия в водной вытяжке, мг/дм3 (находят по графику);
23,0 - молярная масса эквивалента иона натрия, г/моль;
1000 - коэффициент пересчета содержания иона натрия из мг в г.
За результат анализа принимают значение единичного определения иона натрия.
Допускаемые, при вероятности Р = 0,99, отклонения от аттестованного значения стандартного образца или среднеарифметического при выборочном повторном анализе составляют, V%, при молярной концентрации эквивалента ионов натрия:
свыше 0,0020 до 0,0060 моль/дм3 - 9;
свыше 0,0060 до 0,0200 моль/дм3 - 7,5;
свыше 0,0200 моль/дм3 - 6.
5.7. Расчет суммы токсичных солей в водной вытяжке вскрышных и вмещающих пород
При использовании расчетного способа суммируют массовые доли анионов и катионов, образующих в породах токсичные соли.
5.7.1. Расчет токсичных бикарбонат-ионов (НСО3¯)
Бикарбонат-ионы (показатель общей щелочности) с (НСО3¯) в моль/дм3 связывают с ионами кальция с (1/2Са2+) в моль/дм3. Оставшиеся в излишке бикарбонат-ионы (связанные с ионами натрия и магния) являются токсичными.
5.7.2. Расчет токсичных сульфат-ионов (SO42-)
Бикарбонат-ионы, рассчитанные по количеству серной кислоты, израсходованной на титрование по метиловому оранжевому (второе титрование), связывают с ионами кальция. Оставшиеся в излишке ионы кальция вычитают из общего содержания растворимых в воде сульфат-ионов с (1/2SO42-) в моль/дм3.
5.7.3. Измеренные (ионы хлора, натрия и магния) и вычисленные (бикарбонат и сульфат - ионы) молярные концентрации эквивалентов токсичных ионов переводят в их массовые доли (в процентах от массы исследуемых пород). Молярные концентрации эквивалентов токсичных ионов с (l/Z*иона) в их массовые доли (Wиона), %, вычисляют по формуле
![]()
где с (1/Z*иона) - молярная концентрация эквивалента иона в водной вытяжке, моль/дм3;
M(l/Z*иона) - молярная масса эквивалента иона, г/моль.
Числовые значения этой величины в г/моль равны:
20,04 для ионов кальция - М(1/2Са2+);
12,16 для ионов магния - M(l/2Mg2+);
23,00 для ионов натрия - M(Na+);
35,45 для ионов хлора - М(Сl-1);
61,02 для бикарбонат-ионов - М(НСО3¯);
48,03 для сульфат-ионов - M(1/2SО42-);
2 - коэффициент пересчета молярной концентрации эквивалента иона, моль/дм3 в моль/500 см3 (моль/100 г породы).
5.7.4. Сумму токсичных солей в породе - ее массовую долю, %, (W) вычисляют по формуле
W = WCl¯ + WNa+ + WMg2+ + WHCO3¯ (токсичных солей) + WSO42- (токсичных солей),
где WCl¯, WNa+... - массовые доли токсичных анионов и катионов, %.
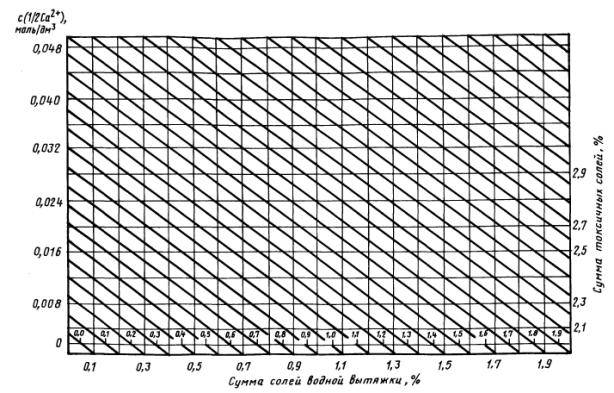
5.8. Расчет суммы токсичных солей графическим методом
Сумму токсичных солей в породах вычисляют по номограмме - по разности между общей суммой солей в водной вытяжке исследуемых пород и наличием в ней нетоксичных соединений - бикарбонатов и сульфатов кальция. Для этого на нижней горизонтальной линии с пометкой «Сумма солей водной вытяжки, %» (массовая доля суммы солей водной вытяжки) находят точку, соответствующую значению этой величины для данной породы (например, 1,5%).
Если водная вытяжка светлая - раствор не содержит коллоидных частиц, за сумму солей принимают значение сухого остатка.
При мутной водной вытяжке сумму солей получают расчетным методом, суммируя массовые доли токсичных и нетоксичных ионов.
По оси ординат находят точку, соответствующую молярной концентрации эквивалента ионов кальция (Са2+) в водной вытяжке породы в моль/дм3 (например 0,012 моль/дм3). От точки пересечения наклонной линии от 1,5 и горизонтальной линии от 0,012 берут проекцию на верхней горизонтальной линии с пометкой «Сумма токсичных солей, %» (массовая доля суммы токсичных солей). В данном случае это точка с отметкой 1,05 %.
Таким образом, при содержании солей в водной вытяжке 1,5% на сухую породу и 0,012 моль/дм3 с (1/2Са2+) количество токсичных солей равно 1,05%.
При наличии в породе хлоридов кальция, когда HCO3¯ + SO42- меньше Са2+, отсчет по оси ординат (см. номограмму) необходимо брать по сумме (моли) ионов НСО3¯ + SO42-, которые в этом случае связываются с кальцием.
Номограмма для расчета суммы токсичных солей по водным вытяжкам