|
|||||||||||||||
Все документы, представленные в каталоге, не являются их официальным изданием и предназначены исключительно для ознакомительных целей. Электронные копии этих документов могут распространяться без всяких ограничений. Вы можете размещать информацию с этого сайта на любом другом сайте.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
УСТАНОВКИ ДИСТИЛЛЯЦИОННЫЕ ОПРЕСНИТЕЛЬНЫЕ СТАЦИОНАРНЫЕ |
ГОСТ |
|
Методы химического анализа дистиллята |
|
|
Stationary distillation desalting units. |
Постановлением Государственного комитета СССР по стандартам от 15 ноября 1985 г. №3612 дата введения установлена
01.01.87
Настоящий стандарт устанавливает методы химического анализа дистиллята на все контролируемые компоненты за исключением газообразных.
Подготовка аппаратуры, реактивов, растворов и общие требования к отбору проб и проведению анализа - по ГОСТ 26449.0-85.
Для приготовления растворов, проведения анализов и мытья посуды используют дистиллированную воду, очищенную, как указано в рекомендуемом приложении.
Содержание
1. МЕТОДЫ ОПРЕДЕЛЕНИЯ СУХОГО ОСТАТКА
1.1. Гравиметрический метод
1.1.1. Сущность метода
Массу сухого остатка определяют выпариванием отфильтрованного объема дистиллята (далее - исследуемого раствора), затем высушиванием при температуре 178-182 ºС и последующим взвешиванием.
Метод применяют при определении массовой концентрации сухого остатка от 5 мг/дм3 и более.
Нижний предел обнаружения составляет 3 мг/дм3.
1.1.2. Аппаратура, реактивы и растворы
Весы аналитические.
Шкаф сушильный.
Баня водяная.
Эксикатор.
Чашки платиновые или фарфоровые вместимостью 100 см3. Фарфоровые чашки применяют при определении массовой концентрации сухого остатка от 50 мг/дм3 и более.
Воронки лабораторные диаметром 50-100 мм.
Фильтры ФОС по ГОСТ 12026-76.
Пипетки без делений вместимостью 25, 50 и 100 см3.
1.1.3. Проведение анализа
Профильтрованный объем исследуемого раствора, содержащий не менее 1 мг сухого остатка, помещают во взвешенную чашку и выпаривают на водяной бане досуха. Чашку с остатком высушивают в сушильном шкафу при температуре 178-182 ºС в течение 2 ч, затем охлаждают в эксикаторе до температуры окружающего воздуха и взвешивают. Последовательные операции высушивания, охлаждения и взвешивания повторяют до достижения постоянной массы чашки с сухим остатком.
1.1.4. Обработка результатов
1.1.4.1. Массовую концентрацию сухого остатка X, мг/дм3, вычисляют по формуле:
![]()
где m1 - масса чашки с сухим остатком, мг;
m2 - масса чашки, мг;
V - объем исследуемого раствора, взятый для анализа, см3.
1.1.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 1.
|
Массовая концентрация сухого остатка, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация сухого остатка, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
3 |
1,9 |
62 |
70 |
3,2 |
5 |
|
5 |
1,9 |
38 |
100 |
3,6 |
4 |
|
10 |
2,0 |
20 |
150 |
4,5 |
3 |
|
20 |
2,2 |
11 |
200 |
6,0 |
3 |
|
40 |
2,5 |
7 |
|
|
|
Примечание к табл. 1-20. При необходимости концентрирования исследуемого раствора значения массовой концентрации определяемых компонентов следует умножать на кратность концентрирования. Допускаемые расхождения в относительных единицах должны соответствовать массовой концентрации определяемых компонентов в концентрированных растворах.
1.2. Электрометрический метод - по ГОСТ 26449.1-85, разд. 3.
2. ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ рН - ПО ГОСТ 26449.1-85.
3. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ПЕРМАНГАНАТНОЙ ОКИСЛЯЕМОСТИ В КИСЛОЙ СРЕДЕ
3.1. Сущность метода
Органические вещества, присутствующие в исследуемом растворе, окисляют марганцовокислым калием в сернокислой среде при кипячении. Избыток марганцовокислого калия восстанавливают щавелевой кислотой. Избыток щавелевой кислоты оттитровывают раствором марганцовокислого калия.
Метод применяют при определении окисляемости в пересчете на массовую концентрацию кислорода от 0,4 мг/дм3 и более.
Нижний предел обнаружения составляет 0,2 мг/дм3.
3.2. Аппаратура, реактивы и растворы
Плитка электрическая.
Колбы мерные вместимостью 1000 см3.
Колбы конические вместимостью 250 см3.
Бюретки вместимостью 25 см3.
Пипетки без делений вместимостью 5, 10 и 100 см3.
Стекла часовые.
Калий марганцовокислый, стандарт-титр.
Калий
марганцовокислый, раствор с молярной концентрацией эквивалента ![]() 0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
Кислота щавелевая, стандарт-титр.
Кислота
щавелевая, раствор с молярной концентрацией эквивалента ![]() 0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра, серной
кислотой, разбавленной 1:15.
0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра, серной
кислотой, разбавленной 1:15.
Кислота серная, разбавленная 1:15 и 1:2. К разбавленной кислоте добавляют раствор марганцовокислого калия до появления слабо-розовой окраски и кипятят в течение 30 мин. При обесцвечивании раствора повторно добавляют раствор марганцовокислого калия до появления слабо-розовой окраски.
3.3. Проведение анализа
В коническую колбу помещают 100 см3 исследуемого раствора, добавляют 5 см3 серной кислоты, разбавленной 1:2, 10 см3 раствора марганцовокислого калия, накрывают колбу часовым стеклом и кипятят в течение 10 мин. В горячий раствор добавляют 10 см3 раствора щавелевой кислоты и титруют раствором марганцовокислого калия до появления слабо-розовой окраски.
3.4. Обработка результатов
3.4.1. Окисляемость в пересчете на массовую концентрацию кислорода X, мг/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора марганцовокислого калия, израсходованный на титрование, см3;
0,08 - масса кислорода, эквивалентная массе марганцовокислого калия в 1 см3 раствора с молярной концентрацией эквивалента 0,01 моль/дм3, мг;
V - объем исследуемого раствора, взятый для анализа, см3.
3.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 2.
Таблица 2
|
Окисляемость в пересчете на массовую концентрацию кислорода, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация сухого остатка, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
0,2 |
0,15 |
75 |
2,0 |
0,18 |
9 |
|
0,4 |
0,15 |
38 |
3,0 |
0,20 |
7 |
|
0,6 |
0,16 |
26 |
4,0 |
0,20 |
5 |
|
0,8 |
0,16 |
20 |
6,0 |
0,24 |
4 |
|
1,0 |
0,16 |
16 |
8,0 |
0,32 |
4 |
|
1,5 |
0,16 |
11 |
|
|
|
4. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ОБЩЕЙ ЩЕЛОЧНОСТИ
4.1. Сущность метода
Общая щелочность обусловлена присутствием в исследуемом растворе солей слабых кислот и гидроксидов. Общую щелочность определяют ацидиметрическим титрованием исследуемого раствора соляной кислотой со смешанным индикатором.
Метод
применяют при определении общей щелочности с молярной концентрацией эквивалента
![]() от 0,10 ммоль/дм3
и более.
от 0,10 ммоль/дм3
и более.
Нижний предел обнаружения составляет 0,05 ммоль/дм3.
4.2. Аппаратура, реактивы и растворы
Колбы мерные вместимостью 1000 см3.
Колбы конические вместимостью 250 см3.
Пипетки без делений вместимостью 50 и 100 см3.
Бюретка вместимостью 25 см3.
Кислота соляная, стандарт-титр.
Кислота
соляная, раствор с молярной концентрацией эквивалента ![]() 0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
Спирт этиловый.
Метиловый красный, индикатор, раствор с массовой концентрацией 2 г/дм3; готовят следующим образом: 0,2 г метилового красного растворяют в 100 см3 этилового спирта.
Метиленовый голубой, индикатор, раствор с массовой концентрацией 1,4 г/дм3; готовят следующим образом: 0,14 г метиленового голубого растворяют в 100 см3 этилового спирта.
Индикатор смешанный; готовят следующим образом: смешивают равные объемы растворов метилового красного и метиленового голубого.
4.3. Проведение анализа
Объем
исследуемого раствора, содержащий соли слабых кислот и гидроксиды в количестве
эквивалентов ![]() от 0,01 до 0,20
ммоль, помещают в коническую колбу, добавляют 3-4 капли смешанного индикатора и
титруют раствором соляной кислоты до перехода окраски раствора из зеленой в
фиолетовую.
от 0,01 до 0,20
ммоль, помещают в коническую колбу, добавляют 3-4 капли смешанного индикатора и
титруют раствором соляной кислоты до перехода окраски раствора из зеленой в
фиолетовую.
4.4. Обработка результатов
4.4.1. Общую щелочность X, ммоль/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора соляной кислоты, израсходованный на титрование, см3;
0,01 - молярная концентрация эквивалента в растворе соляной кислоты, моль/дм3;
V - объем исследуемого раствора, взятый для анализа, см3.
4.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 3.
Таблица 3
|
Общая щелочность, ммоль/дм3 |
Допускаемое расхождение |
Общая щелочность, ммоль/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
||
|
0,05 |
0,034 |
68 |
0,40 |
0,040 |
10 |
|
0,07 |
0,034 |
49 |
0,50 |
0,41 |
8 |
|
0,10 |
0,035 |
35 |
0,60 |
0,44 |
7 |
|
0,15 |
0,036 |
24 |
0,70 |
0,044 |
6 |
|
0,20 |
0,036 |
18 |
0,80 |
0,050 |
6 |
|
0,25 |
0,038 |
15 |
1,00 |
0,050 |
5 |
|
0,30 |
0,038 |
13 |
1,50 |
0,050 |
3 |
5. ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КАРБОНАТОВ И ГИДРОКАРБОНАТОВ - ПО ГОСТ 26449.1-85, РАЗД. 7
6. КОМПЛЕКСОНОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ОБЩЕЙ ЖЕСТКОСТИ
6.1. Метод визуального титрования
6.1.1. Сущность метода - по ГОСТ 26449.1-85, разд. 10.
Метод
применяют при определении общей жесткости с молярной концентрацией эквивалента ![]() от 0,020 ммоль/дм3
и более.
от 0,020 ммоль/дм3
и более.
Нижний предел обнаружения составляет 0,008 ммоль/дм3.
6.1.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 10 (кроме раствора трилона Б).
Трилон
Б, раствор с молярной концентрацией эквивалента ![]() 0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
6.1.3. Проведение анализа
Объем
исследуемого раствора, содержащий соли жесткости в количестве эквивалентов ![]() от 0,01 до 0,20
ммоль, помещают в коническую колбу и далее проводят анализ, как указано в ГОСТ
26449.1-85, разд. 10.
от 0,01 до 0,20
ммоль, помещают в коническую колбу и далее проводят анализ, как указано в ГОСТ
26449.1-85, разд. 10.
6.1.4.Обработка результатов
6.1.4.1. Общую жесткость X, ммоль/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора трилона Б, израсходованный на титрование, см3;
0,01 - молярная концентрация эквивалента в растворе трилона Б, моль/дм3;
V - объем исследуемого раствора, взятый для анализа, см3.
6.1.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 4.
Таблица 4
|
Общая жесткость, ммоль/дм3 |
Допускаемое расхождение |
Общая жесткость, ммоль/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
||
|
0,008 |
0,006 |
75 |
0,100 |
0,008 |
8 |
|
0,012 |
0,006 |
50 |
0,300 |
0,012 |
4 |
|
0,020 |
0,006 |
30 |
0,500 |
0,015 |
3 |
|
0,030 |
0,006 |
20 |
0,700 |
0,021 |
3 |
|
0,040 |
0,006 |
15 |
1,000 |
0,030 |
3 |
|
0,070 |
0,008 |
11 |
|
|
|
6.2. Метод фотометрического титрования
6.2.1. Сущность метода - по ГОСТ 26449.1-85, разд.10.
Метод
применяют при определении общей жесткости с молярной концентрацией эквивалента ![]() от 0,002 ммоль/дм3
и более.
от 0,002 ммоль/дм3
и более.
Нижний предел обнаружения составляет 0,001 ммоль/дм3.
6.2.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 10 (кроме раствора трилона Б и хромогена черного) и перечисленные ниже.
Фотоэлектроколориметр (фотоэлектрический титратор типа ЛМФ-72).
Микробюретка вместимостью 5 см3.
Стаканы химические вместимостью 100 см3.
Трилон
Б, раствор с молярной концентрацией эквивалента ![]() 0,002 моль/дм3
готовят разведением раствора, приготовленного из стандарт-титра.
0,002 моль/дм3
готовят разведением раствора, приготовленного из стандарт-титра.
Спирт этиловый.
Эриохром черный, индикатор; готовят следующим образом: 0,5 г эриохрома черного помещают в мерную колбу вместимостью 100 см3, добавляют 20 см3 буферного раствора, доводят объем раствора до метки спиртом и перемешивают.
6.2.3. Проведение анализа
6.2.3.1. При отсутствии в исследуемом растворе железа, алюминия, меди, цинка, никеля, марганца, карбонатов и гидрокарбонатов
Объем
исследуемого раствора, содержащий соли жесткости в количестве эквивалентов ![]() от 0,0002-0,0050
ммоль, помещают в стакан, добавляют 10 см3 буферного раствора,
90-100 см3 дистиллированной воды и 4-5 капель раствора эриохрома черного.
Раствор титруют, добавляя по 0,1 см3 раствора трилона Б при
перемешивании и измеряя оптическую плотность на фотоэлектроколориметре с
красным светофильтром (длина волны λ = 610 нм). По найденным
значениям оптической плотности и соответствующим им значениям объемов раствора
трилона Б строят кривую титрования. Конечную точку титрования определяют как
точку изменения хода кривой титрования.
от 0,0002-0,0050
ммоль, помещают в стакан, добавляют 10 см3 буферного раствора,
90-100 см3 дистиллированной воды и 4-5 капель раствора эриохрома черного.
Раствор титруют, добавляя по 0,1 см3 раствора трилона Б при
перемешивании и измеряя оптическую плотность на фотоэлектроколориметре с
красным светофильтром (длина волны λ = 610 нм). По найденным
значениям оптической плотности и соответствующим им значениям объемов раствора
трилона Б строят кривую титрования. Конечную точку титрования определяют как
точку изменения хода кривой титрования.
6.2.3.2. При наличии в исследуемом растворе алюминия, железа, никеля, меди, цинка, марганца, карбонатов и гидрокарбонатов
Исследуемый раствор в объеме, указанном в п. 6.2.3.1, помещают в стакан, добавляют 10 см3 раствора триэтаноламина, 1 см3 раствора сернистого натрия, 3-5 капель раствора солянокислого гидроксиламина, 10 см3 буферного раствора и далее проводят анализ, как указано в п. 6.2.3.1.
6.2.4. Обработка результатов
6.2.4.1. Общую жесткость X, ммоль/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора трилона Б, израсходованный на титрование, см3;
0,002 - молярная концентрация эквивалента в растворе трилона Б, моль/дм3;
V - объем исследуемого раствора, взятый для анализа, см3.
6.2.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 5.
Таблица 5
|
Общая жесткость, ммоль/дм3 |
Допускаемое расхождение |
Общая жесткость, ммоль/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
в абсолютных единицах, ммоль/дм3 |
в относительных единицах, % |
||
|
0,001 |
0,00007 |
7 |
0,10 |
0,00020 |
2 |
|
0,002 |
0,00008 |
4 |
0,20 |
0,00040 |
2 |
|
0,005 |
0,00015 |
3 |
0,50 |
0,00100 |
2 |
7. МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЛЬЦИЯ
7.1. Комплексонометрический метод
7.1.1. Сущность метода - по ГОСТ 26449.1-85, разд. 11.
Метод применяют при определении массовой концентрации кальция от 1,6 мг/дм3 и более. Нижний предел обнаружения составляет 0,7 мг/дм3.
7.1.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 11 (кроме раствора трилона Б)
Трилон
Б, раствор с молярной концентрацией эквивалента ![]() 0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
0,01 моль/дм3;
готовят разведением раствора, приготовленного из стандарт-титра.
7.1.3. Проведение анализа
Объем исследуемого раствора, содержащий 0,2-4,0 мг кальция, помещают в коническую колбу и далее проводят анализ, как указано в ГОСТ 26449.1-85, разд. 11.
7.1.4. Обработка результатов
7.1.4.1. Массовую концентрацию кальция X, мг/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора трилона Б, израсходованный на титрование, см3;
0,2 - масса кальция, эквивалентная массе трилона Б в 1 см3 раствора с молярной концентрацией эквивалента 0,01 моль/дм3, мг;
V - объем исследуемого раствора, взятый для анализа, см3.
7.1.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 6.
Таблица 6
|
Массовая концентрация кальция, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация кальция, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
0,7 |
0,53 |
75 |
5,6 |
0,62 |
11 |
|
0,8 |
0,53 |
66 |
8,0 |
0,64 |
8 |
|
1,2 |
0,53 |
44 |
16,0 |
0,80 |
5 |
|
1,6 |
0,53 |
33 |
24,0 |
0,96 |
4 |
|
2,4 |
0,53 |
22 |
32,0 и более |
- |
3 |
|
3,2 |
0,53 |
17 |
|
|
|
7.2. Потенциометрический метод
7.2.1. Сущность метода
Кальций в исследуемом растворе определяют по изменению электродвижущей силы цепи, состоящей из кальцийселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или мономера.
ЭДС цепи изменяется в результате добавления к исследуемому раствору стандартного раствора. Результаты измерения ЭДС обрабатывают графически.
Метод применяют при определения массовой концентрации кальция от 100 до 1000 мкг/дм3
Нижний предел обнаружения составляет 50 мкг/дм3.
7.2.2. Аппаратура, реактивы и растворы
Весы аналитические.
рН-метр лабораторный или иономер с основной погрешностью измерения не более 2,5 мВ для шкалы делений 100-400 мВ.
Электрод измерительный кальцийселективный с электрическим сопротивлением 0,1-3 мОм; в диапазоне молярных концентраций кальция С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (27±3) мВ/рС. Электрод заполняют раствором хлористого кальция с молярной концентрацией 10-3 моль/дм3. Перед измерением электрод выдерживают в течение 24 ч в растворе хлористого кальция с молярной концентрацией 10 4 моль/дм3.
Электрод сравнения хлор серебряный насыщенный по ГОСТ 17792-72.
Термокомпенсатор автоматический с тепловой инерционностью не более 3 мин.
Колбы мерные вместимостью 100 и 1000 см3.
Пипетки с делениями вместимостью 1 и 10 см3.
Натрия гидроокись, раствор с массовой концентрацией 0,4 г/дм3.
Кальций хлористый.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг кальция; готовят следующим образом: 2,769 г хлористого кальция помещают в мерную колбу вместимостью 1000 см3, растворяют в 100-200 см3 дистиллированной воды и доводят объем раствора до метки дистиллированной водой. Массовую концентрацию кальция определяют, как указано в п. 7.1.3.
Рабочий стандартный раствор, 1 см3 раствора содержит 100 мкг кальция; готовят разведением основного стандартного раствора.
Кальций хлористый, раствор с молярной концентрацией 10-3 моль/дм3; готовят следующим образом; 4 см3 основного стандартного раствора помещают в мерную колбу вместимостью 100 см3 и доводят объем раствора до метки дистиллированной водой.
Кальций хлористый, раствор с молярной концентрацией 10-4 моль/дм3; готовят следующим образом; 4 см3 основного стандартного раствора помещают в мерную колбу вместимостью 1000 см3 и доводят объем раствора до метки дистиллированной водой.
7.2.3. Подготовка к проведению анализа
Определение крутизны электродной характеристики
Растворы хлористого кальция с молярной концентрацией С1 = 10-3 моль/дм3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС. По найденным значениям ЭДС Е1 и Е2 и соответствующим им значениям молярной концентрации кальция вычисляют крутизну электродной характеристики S по формуле:
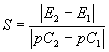
7.2.4. Проведение анализа
В измерительную ячейку помешают 100 см3 исследуемого раствора, 1 см3 раствора гидроокиси натрия, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС. Затем последовательно добавляют 0,2; 0,4; 0,6; 0,8 см3 рабочего стандартного раствора, измеряя значение ЭДС после каждого добавления. По найденным значениям ЭДС и значению крутизны электродной характеристики S вычисляют значение показательной функции F формуле:
![]()
ΔE - абсолютное значение изменения ЭДС после введения в исследуемый раствор стандартного раствора, мВ;
S - крутизна электродной характеристики, мВ/рС;
V - объем исследуемого раствора, взятый для анализа, см3;
Vст - объем стандартного раствора, добавляемый в исследуемый раствор, см3.
По
найденным значениям показательной функции и соответствующим им значениям
объемов рабочего стандартного раствора строят график зависимости ![]() и находят длину
отрезка l, как указано на чертеже.
и находят длину
отрезка l, как указано на чертеже.
7.2.5. Обработка результатов
7.2.5.1. Массовую концентрацию кальция X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса кальция 1 см3 рабочего стандартного в раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
7.2.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 7.
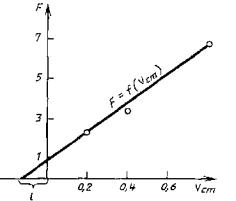
Таблица 7
|
Массовая концентрация кальция, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация кальция, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
50 |
36 |
72 |
600 |
48 |
8 |
|
100 |
38 |
38 |
800 |
48 |
6 |
|
200 |
40 |
20 |
1000 |
50 |
5 |
|
400 |
44 |
11 |
|
|
|
8. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА С ИСПОЛЬЗОВАНИЕМ о-ФЕНАНТРОЛИНА - ПО ГОСТ 26449.1-85, РАЗД. 16
9. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ОБЩЕГО АЗОТА -ПО ГОСТ 26449.1-85, РАЗД. 23
10. МЕТОДЫ ОПРЕДЕЛЕНИЯ АММОНИЙНОГО АЗОТА
10.1. Фотоколориметрический метод
10.1.1. Сущность метода
Ионы аммония при взаимодействии с реактивом Несслера образуют окрашенные в желто-коричневый цвет комплексные соединения йодистого меркураммония. Оптическую плотность раствора измеряют на фотоэлектроколориметре.
Метод применяют при определении массовой концентрации аммонийного азота от 75 до 800 мкг/дм3.
Нижний предел обнаружения составляет 50 мкг/дм3.
10.1.2. Аппаратура, реактивы и растворы Фотоэлектроколориметр.
Колбы мерные вместимостью 50, 100 и 1000 см3.
Пипетки с делениями вместимостью 5 и 10 см3.
Мензурка вместимостью 50 см3.
Реактив Несслера; готовят по ГОСТ 4517-87.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг аммонийного азота; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг аммонийного азота; готовят разведением основного стандартного раствора.
10.1.3. Проведение анализа
В мерную колбу вместимостью 50 см3 помещают объем исследуемого раствора, содержащий 5-40 мкг аммонийного азота, добавляют 1 см3 реактива Несслера, доводят объем раствора дистиллированной водой до метки и перемешивают. Через 3 мин измеряют оптическую плотность раствора на фотоэлектроколориметре с синим светофильтром (длина волны λ = 400-430 нм) в кювете с толщиной поглощающего свет слоя 50 мм. В качестве раствора сравнения используют дистиллированную воду. Массу аммонийного азота в пробе находят по градуировочному графику.
10.1.4. Построение градуировочного графика
В мерные колбы вместимостью по 50 см3 помещают 0,5; 1,0; 2,0; 3,0; 4,0 см3 рабочего стандартного раствора, что соответствует 5, 10, 20, 30, 40 мкг аммонийного азота, добавляют по 30-40 см3 дистиллированной воды, по 1 см3 реактива Несслера и далее проводят анализ, как указано в п. 10.1.3.
По найденным значениям оптической плотности и соответствующим им значениям массы аммонийного азота строят градуировочный график.
10.1.5. Обработка результатов
10.1.5.1. Массовую концентрацию аммонийного азота X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса аммонийного азота в пробе, найденная по градуировочному графику, мкг;
V - объем исследуемого раствора, взятый для анализа, см3.
10.1.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 8.
Таблица 8
|
Массовая концентрация аммонийного азота, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация аммонийного азота, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
50 |
40 |
80 |
400 |
64 |
16 |
|
75 |
41 |
55 |
500 |
70 |
14 |
|
100 |
43 |
43 |
600 |
78 |
13 |
|
150 |
45 |
30 |
700 |
84 |
12 |
|
200 |
50 |
25 |
800 |
88 |
11 |
|
300 |
57 |
19 |
|
|
|
10.2. Потенциометрический метод
10.2.1. Сущность метода
Аммонийный азот в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из аммонийселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера.
Метод применяют при определении массовой концентрации аммонийного азота от 50 до 500 мкг/дм3.
Нижний предел обнаружения составляет 25 мкг/дм3.
10.2.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, термокомпенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Электрод измерительный аммонийселективный с электрическим сопротивлением 5-50 мОм; в диапазоне молярных концентраций аммонийного азота С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (55±4) мВ/рС. Электрод заполняют раствором хлористого аммония с молярной концентрацией 10-1 моль/дм3. Перед измерением электрод выдерживают в течение 24 ч в растворе хлористого аммония с молярной концентрацией 10-3 моль/дм3.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг аммонийного азота; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 100 мкг аммонийного азота; готовят разведением основного стандартного раствора.
Аммоний хлористый, раствор 1 с молярной концентрацией 10-1 моль/дм3; готовят следующим образом: 5,349 г аммония хлористого помещают в мерную колбу вместимостью 1000 см3, растворяют в 100-200 см3 дистиллированной воды, доводят объем раствора до метки дистиллированной водой и перемешивают.
Аммоний хлористый, раствор 2 с молярной концентрацией 10-4 моль/дм3; готовят разведением раствора 1.
Аммоний хлористый, раствор 3 с молярной концентрацией 10-3 моль/дм3; готовят разведением раствора 1.
10.2.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы хлористого аммония с молярной концентрацией С1 = 10-3 моль/дм3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку и далее определяют крутизну электродной характеристики, как указано в п. 7.2.3.
10.2.4. Проведение анализа
В измерительную ячейку помещают 100 см3 исследуемого раствора, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС. Затем последовательно добавляют 0,1; 0,2; 0,4; 0,6; 3,0 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
10.2.5. Обработка результатов
10.2.5.1. Массовую концентрацию аммонийного азота X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса аммонийного азота в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
10.2.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 9.
Таблица 9
|
Массовая концентрация аммонийного азота, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация аммонийного азота, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
25 |
18 |
72 |
300 |
24 |
8 |
|
50 |
19 |
38 |
400 |
24 |
6 |
|
100 |
20 |
20 |
500 |
25 |
5 |
|
200 |
22 |
11 |
|
|
|
11. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ НИТРИТОВ С ИСПОЛЬЗОВАНИЕМ РЕАКТИВА ГРИССА
11.1. Сущность метода
Нитриты, взаимодействуя с сульфаниловой кислотой и α-нафтиламином, образуют окрашенные в розовый цвет соединения. Оптическую плотность раствора измеряют на фотоэлектроколориметре.
Метод применяют при определении массовой концентрации нитритов от 10 до 200 мкг/дм3.
Нижний предел обнаружения составляет 7 мкг/дм3.
11.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр.
Весы аналитические.
Баня водяная.
Колбы мерные вместимостью 50, 100 и 1000 см3.
Пипетки с делениями вместимостью 5 см3.
Реактив Грисса, раствор с массовой концентрацией 6 г/дм3; готовят следующим образом: 3 реактива Грисса растворяют в 500 см3 уксусной кислоты, разбавленной 1:3,5. Раствор хранят в посуде из темного стекла.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг нитритов; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг нитритов; готовят разведением основного стандартного раствора.
11.3. Проведение анализа
В мерную колбу вместимостью 50 см3 помещают объем исследуемого раствора, содержащий 2-10 мкг нитритов, добавляют 1 см3 реактива Грисса, перемешивают и выдерживают на водяной бане при температуре 60-70 ºС в течение 10-15 мин. Затем раствор охлаждают до температуры 20-25 °С, доводят объем раствора дистиллированной водой до метки и перемешивают. Оптическую плотность раствора измеряют на фотоэлектроколориметре с зеленым светофильтром (длина волны λ = 540 нм) в кювете с толщиной поглощающего свет слоя 50 мм. В качестве раствора сравнения используют дистиллированную воду. Массу нитритов в пробе находят по градуировочному графику.
11.4. Построение градуировочного графика
В мерные колбы вместимостью по 50 см3 помещают 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9; 1,0 см3 рабочего стандартного раствора, что соответствует 2, 3, 4, 5, 6, 7, 8, 9, 10 мкг нитритов, добавляют по 10 - 15 см3 дистиллированной воды, по 1 см3 реактива Грисса и далее поступают, как указано в п. 11.3.
По найденным значениям оптической плотности и соответствующим им значениям массы нитритов строят градуировочный график.
11.5. Обработка результатов
11.5.1. Массовую концентрацию нитритов X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса нитритов в пробе, найденная по градуировочному графику, мкг;
V - объем исследуемого раствора, взятый для анализа, см3.
11.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 10.
Таблица 10
|
Массовая концентрация нитритов, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация нитритов, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
7 |
5,6 |
80 |
50 |
8,5 |
17 |
|
10 |
5,7 |
57 |
70 |
9,5 |
14 |
|
15 |
6,0 |
40 |
100 |
12,0 |
12 |
|
20 |
6,4 |
32 |
150 |
15,0 |
10 |
|
30 |
7,0 |
23 |
200 |
18,0 |
9 |
|
40 |
7,6 |
19 |
|
|
|
12. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ НИТРАТОВ
12.1. Сущность метода
Нитраты в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из нитратселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера.
Метод применяют при определении массовой концентрации нитратов от 50 до 500 мкг/дм3.
Нижний предел обнаружения составляет 25 мкг/дм3.
12.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, термокомпенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Электрод измерительный нитратселективный с электрическим сопротивлением 0,1-0,9 мОм в диапазоне молярных концентраций нитратов С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (55±4) мВ/рС. Электрод заполняют раствором азотнокислого калия с молярной концентрацией 10-1 моль/дм3. Перед измерением электрод выдерживают в течение 24 ч в растворе азотнокислого калия с молярной концентрацией 10-4 моль/дм3.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг нитратов; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 100 мкг нитратов; готовят разведением основного стандартного раствора.
Калий азотнокислый, раствор 1 с молярной концентрацией 10-1 моль/дм3; готовят следующим образом: 10,111 г азотнокислого калия помещают в мерную колбу вместимостью 1000 см3, растворяют в 100-200 см3 дистиллированной воды и доводят объем раствора до метки дистиллированной водой.
Калий азотнокислый, раствор 2 с молярной концентрацией 10-3 моль/дм3; готовят разведением раствора 1.
Калий азотнокислый, раствор 3 с молярной концентрацией 10-4 моль/дм3; готовят разведением раствора 1.
12.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы азотнокислого калия с молярной концентрацией С1 = 10-3 моль/дм3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку и далее определяют крутизну электродной характеристики, как указано в п. 7.2.3.
12.4. Проведение анализа
В измерительную ячейку помещают 100 см3 исследуемого раствора, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС. Затем последовательно добавляют 0,2; 0,4; 0,6; 0,8 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
12.5. Обработка результатов
12.5.1. Массовую концентрацию нитратов X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса нитратов в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
12.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 11.
Таблица 11
|
Массовая концентрация нитратов, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация нитратов, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
25 |
18 |
72 |
300 |
24 |
8 |
|
50 |
19 |
38 |
400 |
24 |
6 |
|
100 |
20 |
20 |
500 |
25 |
5 |
|
200 |
22 |
11 |
|
|
|
13. МЕТОДЫ ОПРЕДЕЛЕНИЯ НАТРИЯ
13.1. Пламенно-фотометрический метод
13.1.1. Сущность метода - по ГОСТ 26449.1-85, разд. 17.
Метод применяют при определении массовой концентрации натрия от 10 до 2500 мкг/дм3. Нижний предел обнаружения составляет 5 мкг/дм3.
13.1.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 17 (кроме пламенного фотометра) и перечисленные ниже.
Флаконы полиэтиленовые или фторопластовые.
Банки из полиэтилена или фторопласта.
Пламенный фотометр со шкалой делений по массовой концентрации натрия от 2,5 до 250,0 или от 25,0 до 2500,0 мкг/дм3 с основной погрешностью определения соответственно 5 и 50 мкг/дм3, с интерференционным светофильтром на натрий с длиной волны λ = (589±5) нм.
Рабочий стандартный раствор 1; 1 см3 раствора содержит 10 мкг натрия; готовят разведением стандартного раствора, хранят в банках.
Рабочий стандартный раствор 2; 1 см3 раствора содержит 100 мкг натрия; готовят разведением стандартного раствора, хранят в банках.
13.1.3. Проведение анализа
Исследуемый раствор с массовой концентрацией натрия 10-2500 мкг/дм3 помещают во флакон. Зафиксировав нулевое положение шкалы пламенного фотометра по дистиллированной воде, вводят исследуемый раствор в пламя горелки и определяют силу тока по шкале прибора.
13.1.4. Построение градуировочного графика
В мерные колбы вместимостью по 100 см3 помещают 0,5; 1,0; 1,5; 1,8; 2,0; 2,2 и 2,5 см3 рабочего стандартного раствора 1, дистиллированной водой доводят объемы растворов до метки и перемешивают. Затем в мерные колбы вместимостью по 100 см3 помещают 0,5; 1,0; 1,5; 1,8; 2,0; 2,2 и 2,5 см3 рабочего стандартного раствора 2, дистиллированной водой доводят объемы растворов до метки и перемешивают. Массовая концентрация натрия в растворах соответственно составляет 50, 100, 1501 180, 200, 220, 250 и 500, 1000, 1500, 1800, 2000, 2200, 2500 мкг/дм3.
Полученные растворы помещают во флаконы и далее строят градуировочный график, как указано в п. 13.1.3.
По найденным значениям силы тока и соответствующим им значениям массовой концентрации натрия строят градуировочный график.
13.1.5. Обработка результатов
13.1.5.1. Массовую концентрацию натрия X, мкг/дм3, находят по градуировочному графику.
13.1.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 12 - для шкалы делений по массовой концентрации натрия от 2,5 до 250,0 мкг/дм3 и в табл. 13 - для шкалы делений от 25 до 2500 мкг/дм3.
Таблица 12
|
Массовая концентрация натрия, мкг/дм3 |
Допускаемое расхождение |
|
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
|
|
5 |
4,5 |
90 |
|
10 |
5,0 |
60 |
|
15 |
5,2 |
35 |
|
20 |
5,4 |
27 |
|
30 |
6,0 |
20 |
|
50 |
7,0 |
14 |
|
70 |
7,7 |
11 |
|
100 |
9,0 |
9 |
|
150 |
12,0 |
8 |
|
200 |
14,0 |
7 |
|
250 |
15,0 |
6 |
Таблица 13
|
Массовая концентрация натрия, мкг/дм3 |
Допускаемое расхождение |
|
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
|
|
50 |
45 |
90 |
|
100 |
50 |
60 |
|
150 |
52 |
35 |
|
200 |
54 |
27 |
|
300 |
60 |
20 |
|
500 |
70 |
14 |
|
700 |
77 |
11 |
|
1000 |
90 |
9 |
|
1500 |
120 |
8 |
|
2000 |
140 |
7 |
|
2500 |
150 |
6 |
13.2. Потенциометрический метод
13.2.1. Сущность метода
Натрий в исследуемом растворе определяют при рН не менее 10 по изменению ЭДС цепи, состоящей из натрийселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или мономера.
Метод применяют при определении массовой концентрации натрия от 50 до 500 мкг/дм3. Нижний предел обнаружения составляет 25 мкг/дм3.
13.2.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, термокомпенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Аммиак водный.
Эксикатор.
Чашка фарфоровая вместимостью 100 см3.
Флаконы полиэтиленовые или фторопластовые.
Банки из полиэтилена или фторопласта.
Капельница полиэтиленовая.
Электрод измерительный натрийселективный с электрическим сопротивлением 20-200 мОм; в диапазоне молярных концентраций натрия С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (55±4) мВ/рС. Перед измерением электрод выдерживают в течение 24 ч в растворе хлористого натрия с молярной концентрацией 10-4 моль/дм3.
Основной стандартный раствор; 1 см3 раствора содержит 1 мг натрия; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор; 1 см3 раствора содержит 10 мкг натрия; готовят разведением основного стандартного раствора; хранят в банках.
Натрий хлористый, раствор с молярной концентрацией 10-3 моль/дм3; готовят следующим образом: 23 см3 основного стандартного раствора помещают в мерную колбу вместимостью 100 см3 и доводят объем раствора до метки дистиллированной водой. Раствор хранят в банках.
Натрий хлористый, раствор с молярной концентрацией 10-4 моль/дм3; готовят следующим образом: 23 см3 основного стандартного раствора помещают в мерную колбу вместимостью 1000 см3 и доводят объем раствора до метки дистиллированной водой. Раствор хранят в банках.
Раствор аммиака; готовят следующим образом: флакон с 30-50 см3 дистиллированной воды помещают на решетку эксикатора, на дне которого установлена фарфоровая чашка с аммиаком, и выдерживают в течение 24 ч.
13.2.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы хлористого натрия с молярной концентрацией С1 = 10-3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку и далее определяют крутизну электродной характеристики, как указано в п. 7.2.3.
13.2.4. Проведение анализа
В измерительную ячейку помещают 100 см3 исследуемого раствора, погружают электроды, термокомпенсатор, добавляют раствор аммиака до рН не менее 10 и через 2-3 мин измеряют значение ЭДС. Затем последовательно добавляют 0,2; 0,4; 0,6 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
13.2.5. Обработка результатов
13.2.5.1. Массовую концентрацию натрия X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса натрия в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
13.2.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 14.
Таблица 14
|
Массовая концентрация натрия, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация натрия, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
25 |
18 |
74 |
200 |
22 |
11 |
|
50 |
19 |
38 |
300 |
24 |
8 |
|
75 |
20 |
26 |
400 |
24 |
6 |
|
100 |
20 |
20 |
500 |
25 |
5 |
|
150 |
22 |
15 |
|
|
|
14. МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЛИЯ
14.1. Пламенно-фотометрический метод
14.1.1. Сущность метода - по ГОСТ 26449.1-85, разд. 17.
Метод применяют при определении массовой концентрации калия от 40 до 1000 мкг/дм3. Нижний предел обнаружения составляет 25 мкг/дм3.
14.1.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 18 (кроме пламенного фотометра и раствора хлористого натрия) и перечисленные ниже.
Пламенный фотометр со шкалой делений по массовой концентрации калия от 10 до 1000 мкг/дм3 с основной погрешностью определения 20 мкг/дм3, с интерференционным светофильтром с длиной волны λ = (766±5) нм.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг калия; готовят разведением стандартного раствора.
14.1.3. Проведение анализа
В стакан вместимостью 100 см3 помещают объем исследуемого раствора, содержащий 4-100 мкг калия. Зафиксировав нулевое положение шкалы пламенного фотометра по дистиллированной воде, вводят исследуемый раствор в пламя грелки и определяют силу тока по шкале прибора.
14.1.4. Построение градуировочного графика
В мерные колбы вместимостью по 100 см3 помещают 0,2; 0,5; 1,0; 2,0; 4,0; 6,0; 8,0; 10,0 см3 рабочего стандартного раствора, доводят объемы растворов до метки дистиллированной водой и перемешивают. Массовая концентрация калия в растворах составляет соответственно 20, 50, 100, 200, 400, 600, 800, 1000 мкг/дм3. Полученные растворы помещают в стаканы и далее поступают, как указано в п. 14.1.3.
14.1.5. Обработка результатов
14.1.5.1. Массовую концентрацию калия X, мкг/дм3, находят по градуировочному графику.
14.1.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 15.
Таблица 15
|
Массовая концентрация калия, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация калия, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
25 |
22,6 |
86 |
200 |
46,0 |
23 |
|
40 |
23,6 |
59 |
300 |
60,0 |
20 |
|
50 |
25,0 |
50 |
500 |
85,0 |
17 |
|
70 |
28,0 |
40 |
700 |
112,0 |
16 |
|
100 |
32,0 |
32 |
1000 |
150,0 |
15 |
|
150 |
39,0 |
26 |
|
|
|
14.2. Потенциометрический метод
14.2.1. Сущность метода
Калий в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из калийсе-лективного электрода, электролитического ключа, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера.
Метод применяют при определении массовой концентрации калия от 50 до 500 мкг/дм3.
Нижний предел обнаружения составляет 25 мкг/дм3.
14.2.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, термокомпенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Электрод измерительный калий селективный с электрическим сопротивлением 5-40 мОм; в диапазоне молярных концентраций калия С от 10-4 до 10-1 моль/дм3 крутизна электродной характеристики (55±4) мВ/рС. Электрод заполняют раствором хлористого калия с молярной концентрацией 10-1 моль/дм3. Перед измерением электрод выдерживают в течение 24 ч в растворе хлористого калия с молярной концентрацией 10-4 моль/дм3.
Электролитический ключ с кварцевой нитью; заполняют раствором азотнокислого натрия.
Натрий азотнокислый, раствор с массовой концентрацией 85 г/дм3.
Основной стандартный раствор; 1 см3 раствора содержит 1 мг калия; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор; 1 см3 раствора содержит 100 мкг калия; готовят разведением основного стандартного раствора.
Калий хлористый, раствор 1 с молярной концентрацией 10-1 моль/дм3; готовят следующим образом: 7,455 г хлористого калия помещают в мерную колбу вместимостью 1000 см3, растворяют в 100-200 см3 дистиллированной водой, доводят объем раствора до метки дистиллированной водой и перемешивают.
Калий хлористый, раствор 2 с молярной концентрацией 10-3 моль/дм3; готовят разведением раствора 1.
Калий хлористый, раствор 3 с молярной концентрацией 10-4 моль/дм3; готовят разведением раствора 1.
14.2.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы хлористого калия с молярной концентрацией С1 = 10-3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку с электролитическим ключом и далее поступают, как указано в п. 7.2.3.
14.2.4. Проведение анализа
В измерительную ячейку с электролитическим ключом помещают 100 см3 исследуемого раствора, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС.
Затем последовательно добавляют 0,2; 0,4; 0,6 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
14.2.5. Обработка результатов
14.2.5.1. Массовую концентрацию калия X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса калия в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
14.2.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 16.
Таблица 16
|
Массовая концентрация калия, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация калия, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
25 |
18 |
72 |
400 |
24 |
6 |
|
50 |
19 |
38 |
500 |
25 |
5 |
|
100 |
20 |
20 |
700 |
35 |
5 |
|
200 |
22 |
11 |
1000 |
40 |
4 |
|
300 |
24 |
8 |
|
|
|
15. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ СУЛЬФАТОВ
15.1. Сущность метода
Сульфаты при взаимодействии с ионами бария образуют взвесь сернокислого бария, которую стабилизируют добавлением крахмала. Оптическую плотность раствора измеряют на фотоэлектроколориметре.
Метод применяют при определении массовой концентрации сульфатов от 0,7 до 8,0 мг/дм3.
Нижний предел обнаружения составляет 0,5 мг/дм3.
15.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр.
Колбы мерные вместимостью 25, 100 и 1000 см3.
Пипетки без делений вместимостью 1,5 и 15 см3.
Пипетки с делениями вместимостью 5 см3.
Барий хлористый, раствор с массовой концентрацией 200 г/дм3.
Кислота соляная, раствор с массовой концентрацией 106 г/дм3; готовят следующим образом; 240 см3 соляной кислоты помешают в мерную колбу вместимостью 1000 см3, доводят объем раствора дистиллированной водой до метки и перемешивают.
Крахмал растворимый, раствор с массовой концентрацией 10 г/дм3; готовят по ГОСТ 4517-87.
Основной стандартный раствор; 1 см3 раствора содержит 1мг сульфатов; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор; 1 см3 раствора содержит 0,1 мг сульфатов; готовят разведением основного стандартного раствора.
15.3. Проведение анализа
Объем исследуемого раствора, содержащий 0,02-0,20 мг сульфатов, помещают в мерную колбу вместимостью 25 см3, добавляют 1 см3 раствора соляной кислоты, 3 см3 крахмала и перемешивают в течение 1 мин. Затем добавляют 3 см3 раствора хлористого бария, доводят объем раствора дистиллированной водой до метки и перемешивают в течение 1 мин. Перемешивание раствора повторяют 4 раза с интервалом 10 мин и измеряют оптическую плотность раствора на фотоэлектроколориметре с зеленым светофильтром (длина волны Л = 490 нм) в кювете с толщиной поглощающего свет слоя 50 мм. В качестве раствора сравнения используют дистиллированную воду с добавлением всех реактивов. Массу сульфатов в пробе находят по градуировочному графику.
15.4. Построение градуировочного графика
В мерные колбы вместимостью по 25 см3 помещают 0,2; 0,4; 0,6; 0,8; 1,0; 1,5; 2,0 см3 рабочего стандартного раствора, что соответствует 0,02; 0,04; 0,06; 0,08; 0,10; 0,15; 0,20 мг сульфатов, добавляют по 15 см3 дистиллированной воды, по 1 см3 раствора соляной кислоты и далее поступают, как указано в п. 15.3.
По найденным значениям оптической плотности и соответствующим им значениям массы сульфатов строят градуировочный график.
15.5. Обработка результатов
15.5.1. Массовую концентрацию сульфатов X, мг/дм3, вычисляют по формуле:
![]()
где m - масса сульфатов в пробе, найденная по градуировочному графику, мг;
V - объем исследуемого раствора, взятый для анализа, см3.
15.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 17.
Таблица 17
|
Массовая концентрация сульфатов, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация сульфатов, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
0,5 |
0,40 |
80 |
3,0 |
0,54 |
18 |
|
0,7 |
0,40 |
60 |
5,0 |
0,70 |
14 |
|
1,0 |
0,43 |
43 |
7,0 |
0,84 |
12 |
|
1,5 |
0,45 |
30 |
8,0 |
0,88 |
11 |
|
2,0 |
0,50 |
25 |
|
|
|
16. МЕТОДЫ ОПРЕДЕЛЕНИЯ ХЛОРИДОВ
16.1. Аргентометрический метод - по ГОСТ 26449.1-85, разд. 9
16.2. Меркуриметрический метод - по ГОСТ 26449.1-85, разд. 9
16.3. Фотометрический метод
16.3.1. Сущность метода
Хлориды при взаимодействии с ионами серебра образуют устойчивую взвесь хлористого серебра. Оптическую плотность раствора измеряют на фотоэлектроколориметре.
Метод применяют при определении массовой концентрации хлоридов от 0,3 до 4,0 мг/дм3. Нижний предел обнаружения составляет 0,2 мг/дм3.
16.3.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр.
Весы аналитические.
Колбы мерные вместимостью 25 и 1000 см3.
Цилиндры мерные вместимостью 25 см3.
Пипетки без делений вместимостью 1, 20 и 100 см3.
Серебро азотнокислое, раствор с массовой концентрацией 17 г/дм3.
Кислота азотная, раствор с массовой концентрацией 288 г/дм3; готовят следующим образом: 314 см3 азотной кислоты помещают в мерную колбу вместимостью 1000 см3, доводят объем раствора до метки дистиллированной водой и перемешивают.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг хлоридов; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 0,1 мг хлоридов; готовят разведением основного стандартного раствора.
16.3.3. Проведение анализа
Объем исследуемого раствора, содержащий 0,01-0,10 мг хлоридов, помещают в мерную колбу вместимостью 25 см3, добавляют 1 см3 раствора азотной кислоты, 1 см3 раствора азотнокислого серебра, перемешивая раствор после добавления каждого реактива. Доводят объем раствора дистиллированной водой до метки и перемешивают. Через 20 мин измеряют оптическую плотность раствора на фотоэлектроколориметре с зеленым светофильтром (длина волны λ = 490 нм) в кювете с толщиной поглощающего свет слоя 50 мм. В качестве раствора сравнения используют дистиллированную воду. Массу хлоридов в пробе находят по градуировочному графику.
16.3.4. Построение градуировочного графика
В мерные колбы вместимостью по 25 см3 помещают 0,1; 0,2; 0,4; 0,6; 0,8; 1,0 см3 рабочего стандартного раствора, что соответствует 0,01; 0,02; 0,04; 0,06; 0,08; 0,10 мг хлоридов, добавляют по 1 см3 раствора азотной кислоты и далее поступают, как указано в п. 16.3.3.
По найденным значениям оптической плотности и соответствующим им значениям массы хлоридов строят градуировочный график.
16.3.5. Обработка результатов
16.3.5.1. Массовую концентрацию хлоридов X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса хлоридов в пробе, найденная по градуировочному графику, мг;
V - объем исследуемого раствора, взятый для анализа, см3.
16.3.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 18.
Таблица 18
|
Массовая концентрация хлоридов, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация сульфатов, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
0,2 |
0,16 |
80 |
1,0 |
0,22 |
22 |
|
0,3 |
0,16 |
55 |
1,4 |
0,24 |
17 |
|
0,4 |
0,16 |
42 |
2,0 |
0,28 |
14 |
|
0,6 |
0,18 |
30 |
3,0 |
0,34 |
11 |
|
0,8 |
0,20 |
25 |
4,0 |
0,40 |
10 |
17. МЕТОДЫ ОПРЕДЕЛЕНИЯ МЕДИ
17.1. Экстракционно-фотоколориметрический метод
17.1.1. Сущность метода - по ГОСТ 26449.1-85, разд. 19.
17.1.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 19 и перечисленные ниже.
Плитка электрическая.
Стаканы химические вместимостью 100 см3.
Кислота азотная, разбавленная 1:1.
17.1.3. Проведение анализа
Объем исследуемого раствора, содержащий 5-100 мкг меди, помещают в стакан, добавляют 2-3 см3 азотной кислоты и нагревают до кипения. Раствор охлаждают до температуры 20-25 °С, нейтрализуют раствором аммиака до рН 7, помещают в делительную воронку и далее проводят анализ, как указано в ГОСТ 26449.1-85, разд. 19.
17.1.4. Построение градуировочного графика - по ГОСТ 26449.1-85, разд. 19.
17.1.5. Обработка результатов - по ГОСТ 26449.1-85, разд. 19.
17.2. Потенциометрический метод
17.2.1. Сущность метода
Медь в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из медьселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера.
Метод применяют при определении массовой концентрации меди от 10 до 100 мкг/дм3.
Нижний предел обнаружения составляет 2,5 мкг/дм3.
17.2.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, терм о компенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Электрод измерительный медьселективный с электрическим сопротивлением 0,05-0,07 мОм; в диапазоне молярных концентраций меди Сот 10-5 до 10-2 моль/дм3 крутизна электродной характеристики (28±3) мВ/рС. Перед измерением электрод выдерживают в течение 24 ч в растворе сернокислой меди с молярной концентрацией 10-4 моль/дм3.
Медь сернокислая 5-водная.
Основной стандартный раствор; 1 см3 раствора содержит 1 мг меди; готовят следующим образом: 3,929 г сернокислой меди помещают в мерную колбу вместимостью 1000 см3, растворяют в 100-200 см3 дистиллированной воды, доводят до метки дистиллированной водой и перемешивают.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг меди; готовят разведением основного стандартного раствора.
Медь сернокислая, раствор с молярной концентрацией 10-3 моль/дм3; готовят следующим образом: 6,4 см3 основного стандартного раствора помещают в мерную колбу вместимостью 100 см3, поводят объем раствора до метки дистиллированной водой и перемешивают.
Медь сернокислая, раствор с молярной концентрацией 10~4 моль/дм3; готовят следующим образом: 6,4 см3 основного стандартного раствора помещают в мерную колбу вместимостью 1000 см3, доводят объем раствора до метки дистиллированной водой и перемешивают.
17.2.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы сернокислой меди с молярной концентрацией С1 = 10-3 моль/дм3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку и далее поступают, как указано в п. 7.2.3.
17.2.4. Проведение анализа
В измерительную ячейку помещают 100 см3 исследуемого раствора, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС, затем последовательно добавляют 2, 4,6, 8 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
17.2.5. Обработка результатов
17.2.5.1. Массовую концентрацию меди X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса меди в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l см3;
V - объем исследуемого раствора, взятый для анализа, см3.
17.2.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 19.
Таблица 19
|
Массовая концентрация меди, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация меди, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
2,5 |
1,8 |
72 |
30,0 |
2,4 |
8 |
|
5,0 |
1,9 |
38 |
40,0 |
2,4 |
6 |
|
7,5 |
2,0 |
26 |
50,0 |
2,5 |
5 |
|
10,0 |
2,0 |
20 |
70,0 |
2,8 |
4 |
|
15,0 |
2,2 |
15 |
100,0 и более |
- |
4 |
|
20,0 |
2,2 |
11 |
|
|
|
18. ФОТОКОЛОРИМЕТРИЧЕСКИИ МЕТОД ОПРЕДЕЛЕНИЯ ОБЩЕГО ФОСФОРА С ИСПОЛЬЗОВАНИЕМ ВОССТАНОВИТЕЛЯ - АСКОРБИНОВОЙ КИСЛОТЫ -ПО ГОСТ 26449.1-85, РАЗД. 14
19. ФОТОКОЛОРИМЕТРИЧЕСКИИ МЕТОД ОПРЕДЕЛЕНИЯ РЕАКЦИОННО-СПОСОБНОЙ ДВУОКИСИ КРЕМНИЯ - ПО ГОСТ 26449.1-85, РАЗД. 22
20. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФТОРИДОВ
20.1. Сущность метода
Фториды в исследуемом растворе определяют по изменению ЭДС цепи, состоящей из фторселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и лабораторного рН-метра или иономера.
Метод применяют при определении массовой концентрации фторидов от 10 до 100 мкг/дм3.
Нижний предел обнаружения составляет 2,5 мкг/дм3.
20.2. Аппаратура, реактивы и растворы
Весы, рН-метр, электрод сравнения, термокомпенсатор, колбы и пипетки - по п. 7.2.2 и перечисленные ниже.
Электрод измерительный фтореелективный с электрическим сопротивлением 0,02-1,00 мОм; в диапазоне молярных концентраций фторидов С от 10-5 до 10-1 моль/дм3 крутизна электродной характеристики (56±3) мВ/рС. Перед измерением электрод выдерживают в течение 24 ч в растворе фтористого натрия с молярной концентрацией 10-4 моль/дм5.
Банки из полиэтилена или фторопласта по ГОСТ 3885-73.
Натрий уксуснокислый.
Уксусная кислота.
Буферный раствор, рН 4,5; готовят следующим образом: в мерную колбу вместимостью 1000 см3 помещают 246 г уксуснокислого натрия, 180 г уксусной кислоты и доводят объем раствора до метки дистиллированной водой.
Основной стандартный раствор; 1 см3 раствора содержит 1 мг фторидов; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг фторидов; готовят разведением основного стандартного раствора; хранят в банках.
Натрий фтористый, раствор с молярной концентрацией 10-3 моль/дм3; готовят следующим! образом: 19 см3 основного стандартного раствора помешают в мерную колбу вместимостью 1000 см3, доводят объем раствора до метки дистиллированной водой и перемешивают. Раствор хранят в банках.
Натрий фтористый, раствор с молярной концентрацией 10-4 моль/дм3; готовят следующим образом: 1,9 см3 основного стандартного раствора помешают в мерную колбу вместимостью 1000 см3, доводят объем раствора до метки дистиллированной водой и перемешивают. Раствор хранят в банках.
20.3. Подготовка к проведению анализа заключается в определении крутизны электродной характеристики.
Растворы фтористого натрия с молярной концентрацией С1 = 10-3 и С2 = 10-4 моль/дм3 последовательно помещают в измерительную ячейку и далее подготовку проводят, как указано в п. 7.2.3.
20.4. Проведение анализа
В измерительную ячейку помещают 100 см3 исследуемого раствора, 1 см3 буферного раствора, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС. Затем последовательно добавляют 0,2; 0,4, 0,6, 0,8 см3 рабочего стандартного раствора и далее проводят анализ, как указано в п. 7.2.4.
20.5. Обработка результатов
20.5.1. Массовую концентрацию фторидов X, мкг/дм3, вычисляют по формуле:
![]()
где m - масса фторидов в 1 см3 рабочего стандартного раствора, мкг;
V1 - абсолютное значение объема рабочего стандартного раствора, соответствующее длине отрезка l, см3;
V - объем исследуемого раствора, взятый для анализа, см3.
20.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 20.
|
Массовая концентрация фторидов, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация фторидов, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
2,5 |
1,8 |
74 |
34,0 |
2,4 |
8 |
|
5,0 |
1,9 |
38 |
40,0 |
2,4 |
6 |
|
7,5 |
2,0 |
26 |
50,0 |
2,5 |
5 |
|
10,0 |
2,0 |
20 |
70,0 |
2,8 |
4 |
|
15,0 |
2,2 |
15 |
100,0 |
4,0 |
4 |
|
20,0 |
2,2 |
11 |
|
|
|
ПРИЛОЖЕНИЕ
Рекомендуемое
ОЧИСТКА ДИСТИЛЛИРОВАННОЙ ВОДЫ
В качестве дистиллированной воды, поступающей на очистку (далее - «исходная вода»), используют дистиллят, полученный в лабораторных условиях и на промышленных ДОУ. Массовая концентрация сухого остатка в исходной воде не должна превышать 200 мг/дм3. Удельная электрическая проводимость исходной воды - не более 1000 мк См/см.
1. Лабораторная установка для очистки исходной воды
Принципиальная схема лабораторной установки для очистки исходной воды (черт. 1) состоит из последовательно соединенных между собой фильтров: фильтра грубой очистки, предназначенного для отделения взвешенных частиц; фильтра для отделения органических веществ; H-катионитовых фильтров; анионитового фильтра, комбинированного (катионито-анионитового) фильтра, а также бутылей (канистр) для исходной и очищенной воды на различных стадиях очистки. Схема установки для очистки исходной воды предусматривает возможность регенерации или замены любого из фильтров независимо друг от друга.
Фильтр для отделения органических веществ следует включать в работу лишь при наличии в воде органических веществ.
|
|
|
1 - бутыль с тубусом; 2 - фильтр грубой очистки; 3 - фильтр для отделения органических веществ; 4,5 - Н-катионитовые фильтры; 6 - анионитовый фильтр; 7 - комбинированный (катионито-анионитовый) фильтр; 8 - клапаны; 9-12 - бутыли (канистры) |
2. Аппаратура, реактивы и растворы
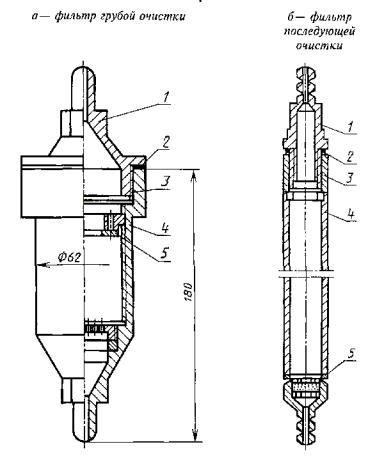
Фильтр грубой очистки - 1 шт. (черт. 2а).
Фильтр (черт. 2б);
для отделения органических веществ - 1 шт.;
Н-катионитовый - 2 шт.;
анионитовый - 1 шт.;
комбинированный (катионито-анионитовый) - 1 шт.
Фильтры представляют собой цилиндрические сосуды, корпуса которых выполнены торга стекла, с герметично уплотненными крышками и штуцерами для подвода исходной и отвода очищенной воды.
Вата медицинская гигроскопическая по ГОСТ 5556-81.
Фильтры
|
|
|
1 - крышка; 2 - кольцо нажимное; 3 - уплотнение; 4 - корпус; 5 - решетка |
Целлюлоза сульфатная беленая по ГОСТ 14940-96.
Уголь активированный марки БАУ-МФ по ГОСТ 6217-74.
Катионит КУ-2-8 по ГОСТ 20298-74.
Анионит АВ-17-8 ГОСТ 20301-74.
Бутыли или канистры полиэтиленовые вместимостью 10 дм3 по ГОСТ 3885-73.
Колба вместимостью 3 дм3.
Стаканы химические стеклянные вместимостью 1 дм3.
Трубки из поливинилхлоридного пластика по ГОСТ 19034-82 или трубки резиновые по ГОСТ 5496-78
Пинцет по ГОСТ 21241-89.
Баня водяная.
Склянка с тубусом вместимостью 10 дм3.
Кислота соляная, раствор с массовой концентрацией 50-70 г/дм3.
Натрия гидроокись, растворы с массовой концентрацией 20 и 50 г/дм3.
Метиловый оранжевый, индикатор; готовят по ГОСТ 4919.1-77.
Фенолфталеин, индикатор; готовят по ГОСТ 4919.1-77.
3. Заполнение фильтров фильтрующими материалами
3.1. Для вытеснения воздуха фильтры заполняют исходной водой через штуцер отвода очищенной воды, после чего загружают влажный фильтрующий материал, поддерживая высоту слоя воды над ни 20 мм. Промывку фильтрующих материалов исходной водой производят со скоростью 10 м/ч.
Вату или целлюлозу помещают в стакан с исходной водой и затем пинцетом переносят в фильтр грубой очистки, соблюдая требования п. 3.1. Рекомендуемая высота фильтрующего слоя - 50-60 мм. Фильтрующий материал промывают исходной водой до полного ее осветления.
3.3. В колбу помещают 1,0-1,5 кг активированного угля, заливают 2 дм3 соляной кислоты, нагретой до 70-80 ºС и выдерживают при периодическом (через 20-30 мин) перемешивании на водяной бане при температуре 95-100 ºС в течение 5-6 ч. Кислоту сливают, активированный уголь промывают 3-4 раза декантацией исходной водой и помещают в фильтр дли отделения органических веществ, соблюдая требования п. 3.1.
3.4 Катионит помещают в стакан с исходной водой и выдерживают в течение 24-26 ч, после чего помещают в Н-катионитовые фильтры, соблюдая требования п. 3.1. Рекомендуемая высота слоя фильтрующего материала - 500-600 мм. Через катионит в течение часа пропускают 0,5 дм3 раствора соляной кислоты температурой 60-65 ºС, после чего катеонит промывают исходной водой до нейтральной реакции с метиловым оранжевым.
3.5 Анионит помещают в стакан с раствором гидроокиси натрия с массовой концентрацией 50 г/дм3, в течение 24-26 ч, после чего помещают в анионитовый фильтр и промывают исходной водой до реакции по фенолфталеину, соблюдая требования п. 3.1. Высота слоя анионита - 500-600 мм.
3.6. Катионит и анионит подготавливают, как указано в пп. 3.4 и 3.5, смешивают в равных объемах и помещают в комбинированный (катионито-анионитовый) фильтр, после чего промывают исходной водой до нейтральной реакции (рН 6,5-7,0), соблюдая требования п. 3.1.
Высота слоя фильтрующего материала - 400-500 мм.
4. Контроль работы установки
Контроль работы установки осуществляют но удельной электрической проводимости очищенной воды, определяемой по ГОСТ 26449.1-85, разд. 3.
Удельная электрическая проводимость очищенной воды при температуре 20-25 ºС не должна превышать 1 мк См/см.
5. Хранение очищенной воды
Очищенную воду хранят в предварительно обработанных полиэтиленовых бутылях (канистрах). Обработку производят следующим образом: бутыль (канистру) заполняют раствором гидроокиси натрия с массовой концентрацией 20 г/дм3, выдерживают в течение 24-26 ч, затем отмывают исходной водой до нейтральной реакции по фенолфталеину и промывают очищенной водой. Бутыль (канистру) заполняют очищенной водой, выдерживают в речение 24 ч и определяют массовую концентрацию натрия, как указано в разд. 13 настоящего стандарта. Если массовая концентрация натрия не превышает 5 мкг/дм3, то бутыль (канистра) пригодна для хранения очищенной воды.